Biologie et
immunologie
du paludisme

Nos recherches visent à élucider les aspects fondamentaux de l’infection du foie par Plasmodium, l’agent du paludisme, dans le but d’identifier et valider de nouvelles cibles de vaccins et de médicaments.
Plasmodium est transmis par un moustique sous la forme de sporozoïtes, qui infectent le foie de l’hôte pour un premier cycle de réplication.
Forts de notre expertise en biologie des stades sporozoïtes et hépatiques et de nos découvertes de facteurs d’hôte et du parasite jouant un rôle clé lors de l’infection, nous développons des projets explorant les mécanismes d’entrée des sporozoïtes, le développement des formes hépatiques et la formation des hypnozoïtes, la régulation des gènes lors de la transmission, ainsi que l’immunité contre les stades hépatiques de l’infection.
Mots Clés : Paludisme – Plasmodium – Sporozoïtes – Hypnozoïtes – Vaccins et médicaments
Les membres de l'équipe
Nos recherches se déclinent en 4 axes
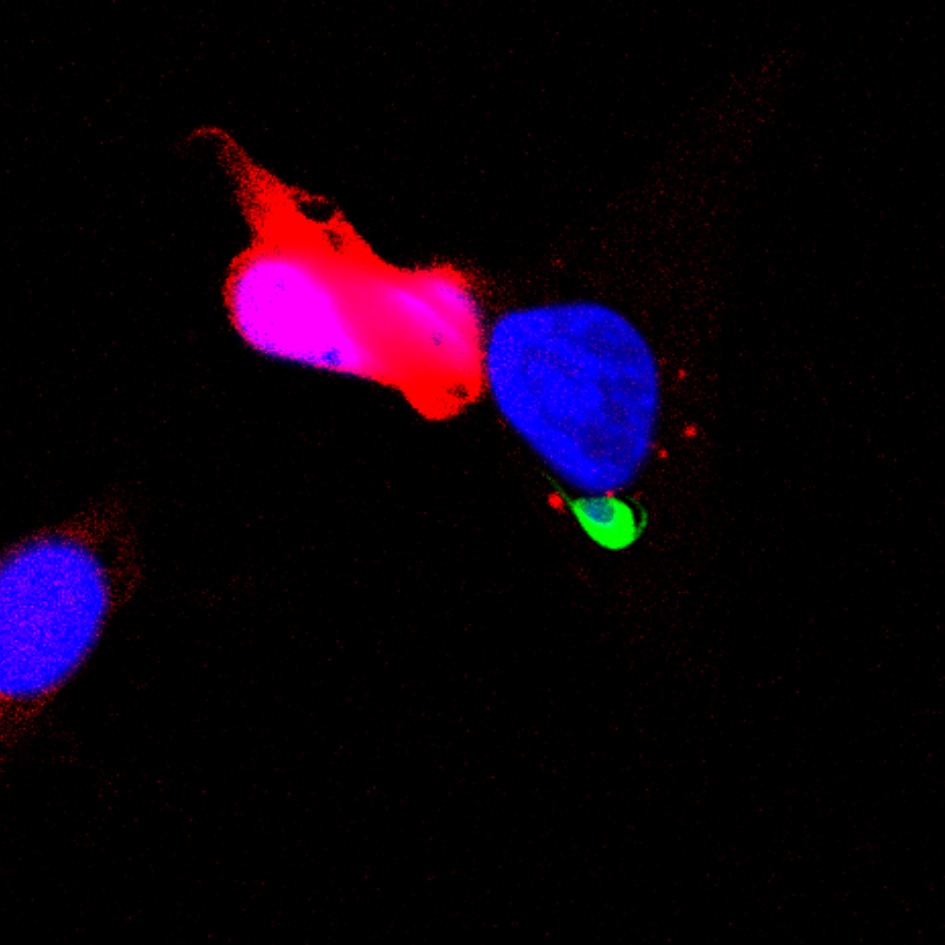
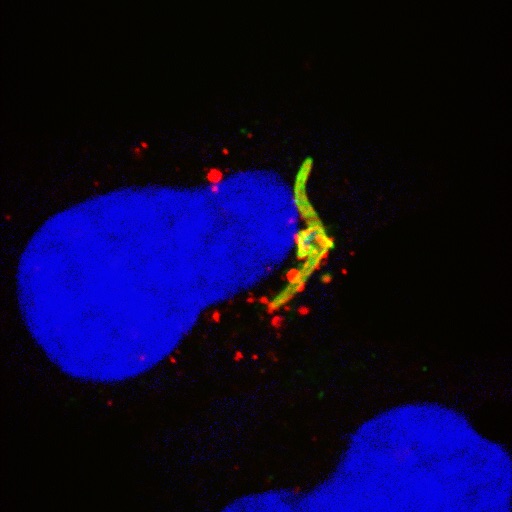
1. Mécanismes d’entrée des sporozoïtes dans les hépatocytes
Une stratégie efficace pour prévenir l’infection initiale du foie consiste à interférer avec les interactions moléculaires hôte-parasite permettant l’entrée des sporozoïtes dans les cellules.
Notre équipe a découvert des voies d’entrée cellulaires et identifié des protéines clés de l’hôte et du parasite impliquées dans le processus d’entrée. Notre objectif est d’élucider les mécanismes d’action de ces acteurs moléculaires et d’évaluer des cibles potentielles pour la conception de nouveaux vaccins antipaludiques.
À cette fin, nous combinons des approches de génétique expérimentale et des modèles cellulaires in vitro, en utilisant des parasites murins et humains.
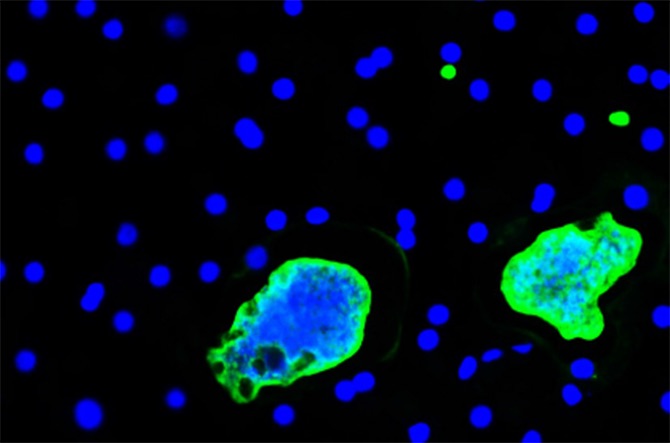
2. Biologie des hypnozoïtes
Certaines espèces de Plasmodium telles que P. vivax produisent des formes dormantes appelées hypnozoïtes, qui peuvent se réactiver et provoquer des rechutes longtemps après la transmission par un moustique. Notre groupe a développé des modèles cellulaires robustes pour la culture in vitro à long terme des hypnozoïtes, et un modèle de souris humanisées pour des études in vivo.
Ces modèles servent à explorer les mécanismes de la dormance et à rechercher des composés capables de tuer les hypnozoïtes ou de les activer pour des stratégies «wake and kill».
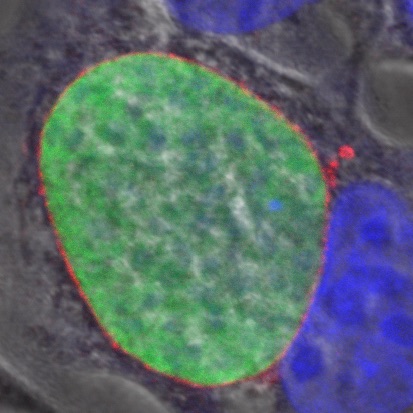
3. Immunité cellulaire médiée par les cellules T contre les formes hépatiques de Plasmodium
Dans les modèles murins, les cellules T CD8+ cytotoxiques jouent un rôle majeur dans l’immunité protectrice dirigée contre les formes hépatiques du paludisme. Cependant, notre connaissance de l’immunité chez l’homme contre les stades hépatiques du paludisme reste limitée.
De plus, la nature des antigènes protecteurs n’est toujours pas définie.
En utilisant des parasites transgéniques exprimant des épitopes de cellules T humaines ainsi que des systèmes expérimentaux in vitro et in vivo robustes mis en place dans le laboratoire, y compris des modèles de souris humanisées et de cultures cellulaires 3D, nous étudions les réponses des cellules T CD8+ humaines spécifiques des formes hépatiques du parasite et recherchons de nouvelles cibles antigéniques protectrices.
Notre objectif ultime est d’identifier les corrélats de protection, avec des implications potentielles pour la conception de vaccins antipaludiques de nouvelle génération.
4. Biologie des tétraspanines
Les tétraspanines forment une famille de protéines transmembranaires conservées au cours de l’évolution, qui jouent un rôle clé dans de nombreux processus physiologiques.
Nous avons découvert le rôle de CD81 et CD9 dans la fusion de cellules musculaires lors de la régénération musculaire, et avons montré que les tétraspanines TspanC8 interagissent directement avec la métalloprotéase ADAM10 et régulent la signalisation via le substrat d’ADAM10 Notch.
Nous avons également contribué à définir le rôle de CD81 lors d’infections par Plasmodium et Listeria. Notre travail vise à comprendre le fonctionnement des tétraspanines et leur capacité à organiser un réseau dynamique d’interactions à la surface de la cellule.
Les opportunités
- Nouvelles stratégies vaccinales contre le paludisme
- Criblage de molécules actives contre les formes hépatiques de Plasmodium
- Découverte antigénique, corrélats de protection
Les publications
Azithromycin disrupts apicoplast biogenesis in replicating and dormant liver stages of the relapsing malaria parasites Plasmodium vivax and Plasmodium cynomolgi. Int J Antimicrob Agents. 2024 May;63(5):107112. doi: 10.1016/j.ijantimicag.2024.107112. Epub 2024 Feb 15.
Differential proteomics argues against a general role for CD9, CD81 or CD63 in the sorting of proteins into extracellular vesicles. J Extracell Vesicles. 2023 Aug;12(8):e12352. doi: 10.1002/jev2.12352.
The claudin-like apicomplexan microneme protein is required for gliding motility and infectivity of Plasmodium sporozoites. PLoS Pathog. 2023 Mar 16;19(3):e1011261. doi: 10.1371/journal.ppat.1011261. eCollection 2023 Mar.
Plasmodium sporozoites require the protein B9 to invade hepatocytes. iScience. 2023 Jan 25;26(2):106056. doi: 10.1016/j.isci.2023.106056. eCollection 2023 Feb 17.
The AMA1-RON complex drives Plasmodium sporozoite invasion in the mosquito and mammalian hosts. PLoS Pathog. 2022 Jun 22;18(6):e1010643. doi: 10.1371/journal.ppat.1010643. eCollection 2022 Jun.
Artemisinin-independent inhibitory activity of Artemisia sp. infusions against different Plasmodium stages including relapse-causing hypnozoites. Life Sci Alliance. 2021 Dec 2;5(3):e202101237. doi: 10.26508/lsa.202101237. Print 2022 Mar.
Low immunogenicity of malaria pre-erythrocytic stages can be overcome by vaccination. EMBO Mol Med. 2021 Apr 9;13(4):e13390. doi: 10.15252/emmm.202013390. Epub 2021 Mar 11.
Plasmodium P36 determines host cell receptor usage during sporozoite invasion. Elife. 2017 May 16;6:e25903. doi: 10.7554/eLife.25903.
Malaria Sporozoites Traverse Host Cells within Transient Vacuoles. Cell Host Microbe. 2015 Nov 11;18(5):593-603. doi: 10.1016/j.chom.2015.10.006.
Persistence and activation of malaria hypnozoites in long-term primary hepatocyte cultures. Nat Med. 2014 Mar;20(3):307-12. doi: 10.1038/nm.3461. Epub 2014 Feb 9.
Plasmodium falciparum full life cycle and Plasmodium ovale liver stages in humanized mice. Nat Commun. 2015 Jul 24;6:7690. doi: 10.1038/ncomms8690.
Normal muscle regeneration requires tight control of muscle cell fusion by tetraspanins CD9 and CD81. Nat Commun. 2013;4:1674. doi: 10.1038/ncomms2675.