Etude et manipulation
de la tolérance
en Immunopathologie

Nous étudions la réponse immune dirigée contre les virus, en particulier ceux associés à l’auto-immunité ou aux déficits immunitaires, ainsi que, plus récemment, le SARS-CoV-2. Nous postulons que des anticorps ciblant des autoantigènes, actifs comme compétiteurs spécifiques, ou utilisés pour rediriger des cellules T régulatrices pourraient représenter de nouvelles formes de thérapies personnalisées.
Nous travaillons à présent à la génération d’anticorps monoclonaux humains thérapeutiques dérivés de patients dans le but de développer i) des compétiteurs spécifiques d’auto-anticorps toxiques, ii) des récepteurs T chimériques (CAR) exprimés à la surface de cellules T régulatrices et iii) de nouvelles stratégies permettant de restaurer l’homéostasie entre immunité et microbiote dans différentes situations de dysbiose.
Mots clés : IgA – Treg – Microbiote – Génie génétique des anticorps humains – Auto-immunité – Immunité antivirale
Les membres de l'équipe
Nos recherches se déclinent en 3 axes
1. Interface hôte / microbiote en santé et Immunopathologie
Il est maintenant bien établi qu’une collaboration altérée entre l’hôte et son microbiote dans un état de dysbiose du tube digestif peut avoir des effets importants sur l’immunité, comme nous l’avons récemment observé dans la sclérose en plaques.
Ce déséquilibre serait à l’origine de complications systémiques associées au déficit en anticorps, comme le déficit immunitaire commun variable (DICV) ou le déficit en IgA. Notre programme de recherche a pour but d’apporter la preuve de concept de l’utilité de nouvelles formes de supplémentation en anticorps permettant de réguler la dysbiose.
Une grande partie de ce programme consiste en évaluation de l’efficacité de cocktails d’anticorps IgA à interagir avec différents motifs bactériens et à prévenir ou réguler l’état de dysbiose. Les effets de ces préparations d’anticorps monoclonaux et polyclonaux sont évalués à l’aide de modèles expérimentaux murins de déficit en IgA.
In fine, notre laboratoire est activement engagé dans la génération et l’analyse d’anticorps spécifiques de pathobiontes dans le but de proposer de nouvelles approches thérapeutiques de la prévention ou du traitement des colites pseudo-membraneuses.
In fine, notre laboratoire est activement engagés dans la géneration et l’analyse d’anticorps spécifiques de pathobiontes dans le but de proposer de nouvelles approches de la prévention ou du traitement des colites pseudo membraneuses.
2. Anticorps humains thérapeutiques
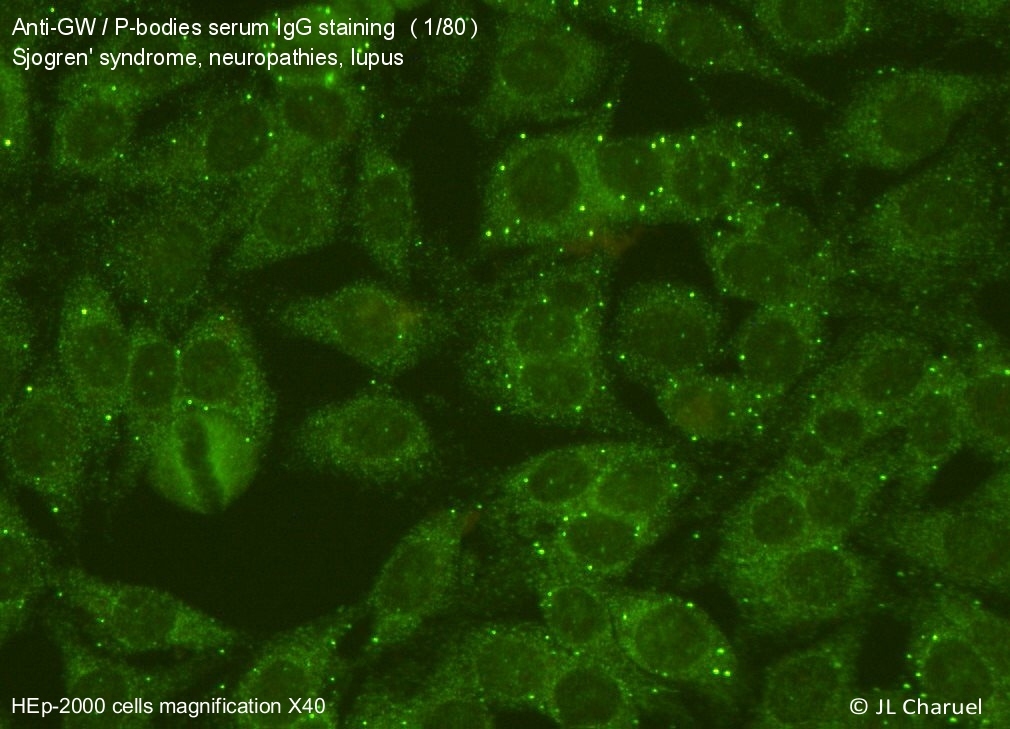
La pathogénie de certaines maladies, ou la génération d’une réponse immune inefficace, sont directement liée à l’action des auto-anticorps. Notre laboratoire a développé un projet ayant pour but d’isoler ces anticorps pathologiques, dérivés des cellules B de patients affectés de différentes formes d’auto-immunité, et de créer des anticorps bloquants thérapeutiques capables d’entrer en compétition avec les anticorps pathogènes.
Ces anticorps seraient utiles sous forme soluble ou sous la forme de récepteurs T chimériques (CAR, voir plus bas). Ce concept du “retournement” d’auto-anticorps pathologique pour une utilisation en biothérapie pourrait être appliqué à une large variété de pathologies (syndrome de Devic, COVID-19, auto-immunité associée au déficit en anticorps de l’adulte).
Les auto-anticorps pourraient aussi représenter d’intéressantes ressources biotechnologiques. Nous avons en effet contribué à la description récente d’anticorps neutralisants dirigés contre les interférons de type 1 chez certains cas de COVID -19 particulièrement sévères.
Les anticorps monoclonaux correspondants pourraient étendre les possibilités actuelles de détection des cytokines par la technologie d’ELISA digitale (SIMOA) ou pour traiter les patients lupiques présentant une augmentation de l’expression des gènes régulés par les interférons de type I (“signature interféron”).
3. Thérapie cellulaire régulatrice et anti-cancer
La manipulation des lymphocytes T régulateurs (Tregs) est une stratégie thérapeutique prometteuse en auto-immunité et en transplantation. Toutefois, le phénotype, l’épigénétique et la fonction des Tregs humains étant instables, il est nécessaire d’optimiser les conditions de culture pour leur expansion in vitro avant leur utilisation en thérapie cellulaire.
A l’aide des dernières avancées technologiques d’analyses, dites MultiOmiques, nous étudions ces cellules à l’échelon uni-cellulaire dans la maladie IPEX et dans nos essais en cours de phase I de thérapie cellulaire dans la transplantation rénale et hépatique. Compte-tenu de l’observation que les Treg jouent également un rôle important dans la réparation tissulaire, en particulier dans des conditions inflammatoires, nous prévoyons donc de manipuler les Treg tissulaires afin de proposer de nouvelles stratégies thérapeutiques de médecine régénérative.
CD15s (sialyl Lewis x), une molécule membranaire exprimée par les Treg, permet la transmigration des leucocytes dans les tissus via son interaction avec l’E-selectine (CD62-E) lors du processus d’exofucosylation. La manipulation du CD15s peut augmenter l’efficacité anti-tumorale des CAR T cells CD4+ et CD8+ in vivo en améliorant leur migration dans les tumeurs et nous en évaluons l’effet dans différents modèles précliniques de tumeur.
Finalement, notre programme s’intéresse aussi au développement de cellules CAR Treg, une population prometteuse sur le plan thérapeutique pour le traitement des tumeurs solides.
Les opportunités
- Essais cliniques de thérapie cellulaire Treg en transplantation et en auto-immunité
- Supplémentation orale IgA du deficit en IgA
- Biomarqueurs microbiotiques associées à l’immunopathologie dans un contexte auto-immun ou de déficit immunitaire
- Anticorps humains monoclonaux thérapeutiques dérivés de patients
- Anticorps humains diagnostiques dérivés de patients
Les publications
Serum and Salivary IgG and IgA Response After COVID-19 Messenger RNA Vaccination. JAMA Netw Open. 2024 Apr 1;7(4):e248051. doi: 10.1001/jamanetworkopen.2024.8051.
Intestinal Candida albicans overgrowth in IgA deficiency. J Allergy Clin Immunol. 2023 Sep;152(3):748-759.e3. doi: 10.1016/j.jaci.2023.03.033. Epub 2023 May 9.
T-independent responses to polysaccharides in humans mobilize marginal zone B cells prediversified against gut bacterial antigens. Sci Immunol. 2023 Jan 27;8(79):eade1413. doi: 10.1126/sciimmunol.ade1413. Epub 2023 Jan 27.
Serum interferon-α levels and IFN type I-stimulated genes score perform equally to assess systemic lupus erythematosus disease activity. Ann Rheum Dis. 2022 Jun;81(6):901-903. doi: 10.1136/annrheumdis-2021-221835. Epub 2022 Jan 28. PMID: 35091421 Free article
Phenotypic Heterogeneity of Fulminant COVID-19–Related Myocarditis in Adults. J Am Coll Cardiol. 2022 Jul 26;80(4):299-312. doi: 10.1016/j.jacc.2022.04.056. PMID: 35863846 Free PMC article.
A comparison of Sars-Cov-2 vaccine platforms: the CoviCompare project. Nat Med. 2022 May;28(5):882-884. doi: 10.1038/s41591-022-01785-4. PMID: 35513532 Free article.
Vaccine breakthrough hypoxemic COVID-19 pneumonia in patients with auto-Abs neutralizing type I IFNs. Sci Immunol. 2022 Jun 14:eabp8966. doi: 10.1126/sciimmunol.abp8966. Online ahead of print. PMID: 35857576 Free PMC article.
Lower disease activity but higher risk of severe COVID-19 and herpes zoster in patients with systemic lupus erythematosus with pre-existing autoantibodies neutralising IFN-α. Ann Rheum Dis. 2022 Dec;81(12):1695-1703. doi: 10.1136/ard-2022-222549. Epub 2022 Aug 16. PMID: 35973806
The risk of COVID-19 death is much greater and age dependent with type I IFN autoantibodies. Proc Natl Acad Sci U S A. 2022 May 24;119(21):e2200413119. doi: 10.1073/pnas.2200413119. Epub 2022 May 16. PMID: 35576468 Free article.
Perturbed Microbiota/Immune Homeostasis in Multiple Sclerosis. Neurol Neuroimmunol Neuroinflamm. 2021 May 11;8(4):e997. doi: 10.1212/NXI.0000000000000997. Print 2021 Jul.
Histiocytosis. Lancet. 2021 Jul 10;398(10295):157-170. doi: 10.1016/S0140-6736(21)00311-1. Epub 2021 Apr 23.