Insectarium
Le Cimi dispose d’un insectarium consacré à l’élevage d’une colonie de moustiques Anopheles stephensi, vecteur du parasite Plasmodium, l’agent du paludisme.
Cet espace permet l’élevage des moustiques, des stades larvaires aquatiques jusqu’aux insectes adultes.
Ce plateau dispose d’un module entièrement dédié à l’infection de moustiques par des plasmodies de rongeurs (P. berghei, P. yoelii). Son fonctionnement est assuré par un personnel hautement qualifié (responsable: Jean-François Franetich, assisté par Maurel Tefit et Thierry Houpert).
Notre insectarium assure la production en routine de sporozoïtes, la forme infectieuse du parasite contenue dans les glandes salivaires des moustiques infectés. Le laboratoire dispose également d’un espace sécurisé pour l’infection de moustiques par des parasites simiens (P. cynomolgi). La production de parasites au sein de notre insectarium est un élément central de nos recherches fondamentales sur les mécanismes de l’infection par Plasmodium et pour le développement de nouvelles stratégies vaccinales ou thérapeutiques contre le paludisme.

Plateau Imagerie
La plateforme d’imagerie du Cimi est centrée autour de plusieurs microscopes :
Le Cimi dispose d’un plateau de microscopie à fluorescence pour l’imagerie de cellules vivantes, notamment pour l’étude des interactions hôtes-pathogènes, ou de matériel fixé. Un microscope Zeiss Axio Observer installé dans un environnement sécurisé de type L2 permet l’observation de cellules vivantes, notamment dans des contextes d’infection.

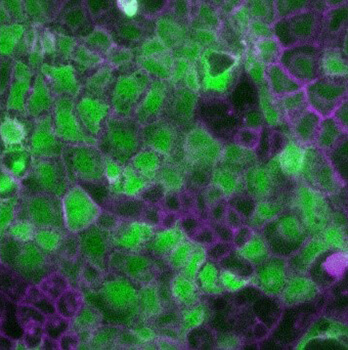
Ce microscope à champs large est entièrement automatisé et équipé d’un système de régulation de la température et du CO2 pour l’imagerie de longue durée de cellules vivantes. Il dispose d’une gamme d’objectifs et filtres et permet des acquisitions multidimensionnelles rapides. Le laboratoire dispose également d’un microscope Zeiss Axio Imager Z1 équipé d’un système Apotome, idéal pour l’analyse d’échantillons fixés. Le CIMI a également accès à un microscope biphoton, implanté dans les locaux de l’UMS28, permettant l’imagerie dynamique in vivo ou ex vivo de tissu vivant.
Équipements
- Zeiss Axio Observer
- Zeiss Axio Imager Z1- Apotome
- Zeiss 7MP two-photon
Plateau SIMOA
De nombreuses molécules sécrétées dans les fluides biologiques peuvent constituer des biomarqueurs dans un contexte pathologique ou de suivi thérapeutique.
Afin de permettre la détection précise et sensible de ces biomarqueurs, le Cimi a implémenté la technologie Simoa (Single Molecule Arrays), développée par la société Quanterix.
Cette technique, encore appelée ELISA digital, permet un dosage ultrasensible sur billes, de l’ordre du femtogramme/mL (10-15 g/mL), dans divers fluides biologiques (sérum, plasma, liquide céphalorachidien, lavage bronchoalvéolaire , surnageant de cultures).
 L’analyseur Simoa HD1 permet le dosage Simoa complètement automatisé
L’analyseur Simoa HD1 permet le dosage Simoa complètement automatisé
 Le système SP-X est une ELISA multiplex très sensible (jusque 10 biomarqueurs par puits).
Le système SP-X est une ELISA multiplex très sensible (jusque 10 biomarqueurs par puits).
 Le système SR-X permet la lecture ultrasensible en Simoa multiplex (jusque 6 analytes/puits)
Le système SR-X permet la lecture ultrasensible en Simoa multiplex (jusque 6 analytes/puits)
Le plateau Quanterix du Cimi inclut trois analyseurs, les systèmes SR-X et SP-X permettant des analyses multiples simultanées (jusqu’à 10 analytes par puits), et un système HD-1 pour des dosages totalement automatisés.
Les kits de dosage sont commercialisés par la société Quanterix et des kits « maison (homebrew) » peuvent également être développés (www.quanterix.com).
Le plateau technique est ouvert aux équipes extérieures au Cimi.
Plateau Cytométrie
Instruments
La cytométrie de flux est l’une des activités au cœur de très nombreux projets de recherche menés au sein du Cimi. Cette technologie permet d’étudier l’expression de molécules (ex. protéines, lipides, sucres, ADN) à l’échelle de la cellule afin de nous fournir des informations sur sa fonctionnalité (ex. état de différenciation, statut d’activation, survie et prolifération cellulaire).
Le principe de la cytométrie de flux consiste à marquer des cellules en suspension à l’aide d’une molécule couplée à un fluorochrome (ex. anticorps couplé à la phycoérythrine), puis de lire la fluorescence émise après excitation par un laser.
Notre parc de cytométrie du Cimi est équipé par une variété large de cytomètres de flux (cytomètres d’analyse et cytomètres de tri cellulaire) incluant les dernières technologies pour réaliser des analyses basées sur des systèmes d’acquisition rapides et/ou à multiples dimensions. Nos instruments sont placés sous la responsabilité d’un personnel technique hautement qualifié.
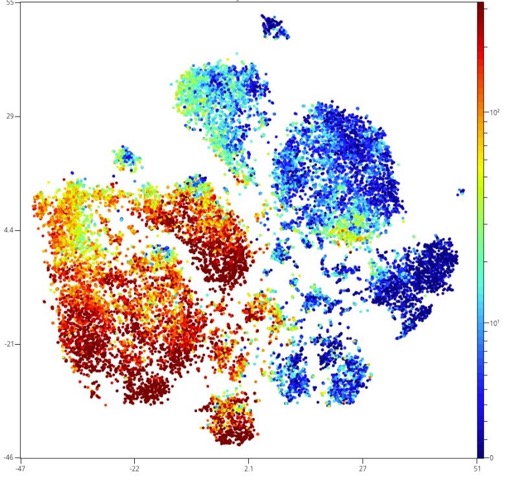
Cytomètres d’analyse :
- 1 Cytek cytomètre spectral AURORA (5 lasers, 40 paramètres). Équipement ouvert à la réservation par des équipes de recherche externes au CIMI via la plateforme de cytométrie CyPS (http://www.cytometrie.pitie-salpetriere.upmc.fr/)
- 1 BD LSR Fortessa (5 lasers, 20 paramètres)
- 1 Beckman Cytoflex S (4 lasers, 14 paramètres)
- 1 DX Flex (3 lasers, 13 paramètres)
- 1 Beckman Cytoflex (2 lasers, 4 paramètres)
Cytomètres de tri cellulaire :
- 1 trieur BD Aria III
- 1 trieur BioRad S3
Organisation
Le parc de cytométrie est piloté par un Comité local appelé FlowPil co-dirigé par les Drs. Marie-Caroline Dieu-Nosjean et Alexandre Boissonnas, placé sous l’autorité du Comité de Direction du Cimi. Le FlowPil gère le bon fonctionnement et la disponibilité des différents instruments, apporte des solutions aux problèmes rencontrés par les utilisateurs et assure une veille technologique et stratégique pour adapter notre parc de cytométrie aux besoins de notre recherche.