Chimiokines,
Phagocytes
et Inflammation

Le travail de notre équipe se concentre sur l’origine et la fonction des cellules myéloïdes dans les maladies infectieuses et le cancer. Il s’agit de déchiffrer la régulation des activités pro et anti-inflammatoires délivrées par ces cellules du système immunitaire inné. Nous tentons ausside comprendre comment cet équilibre peut évoluer vers une réponse dysfonctionnelle et aggraver la pathologie. Notre équipe a développé une expertise dans l’immuno-surveillance multiparamétrique des cellules myéloïdes chez les patients et in vivo dans les modèles précliniques de souris, telles que, la cytométrie spectrale et de masse, les analyses transcriptomiques, ainsi que des processus d’imagerie optique non linéaire de pointe.
Mots clés : Cellules myéloïdes – Inflammation – Infection – Cancer – Chemokines – Imagerie en direct
Les membres de l'équipe
Nos recherches se déclinent en 3 axes
1. Dynamique de la réponse myéloïde
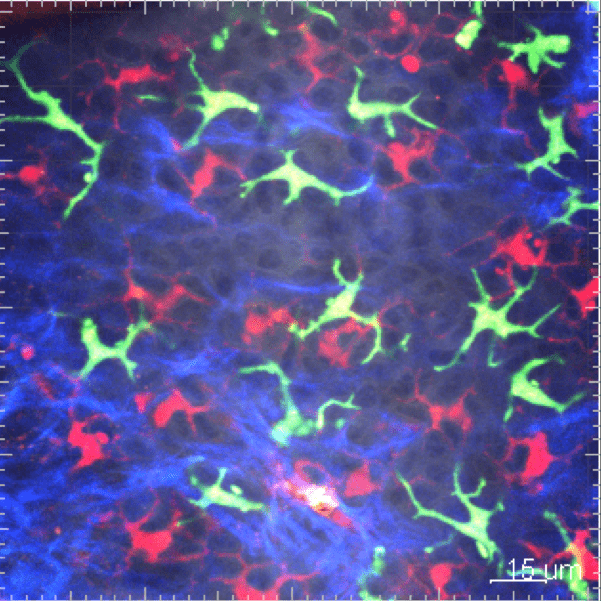
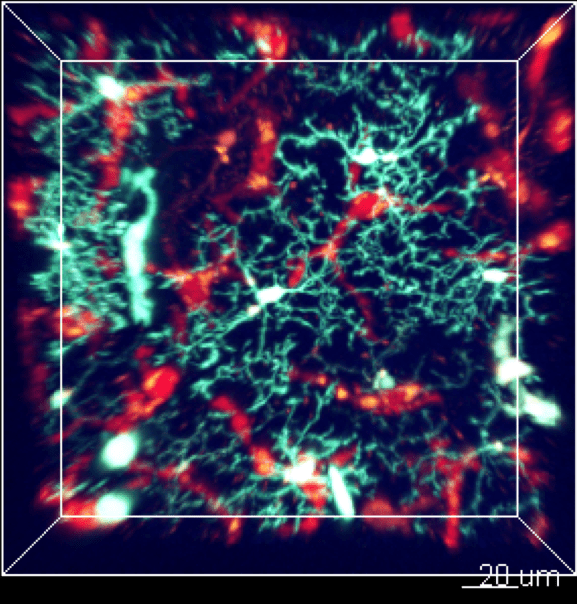
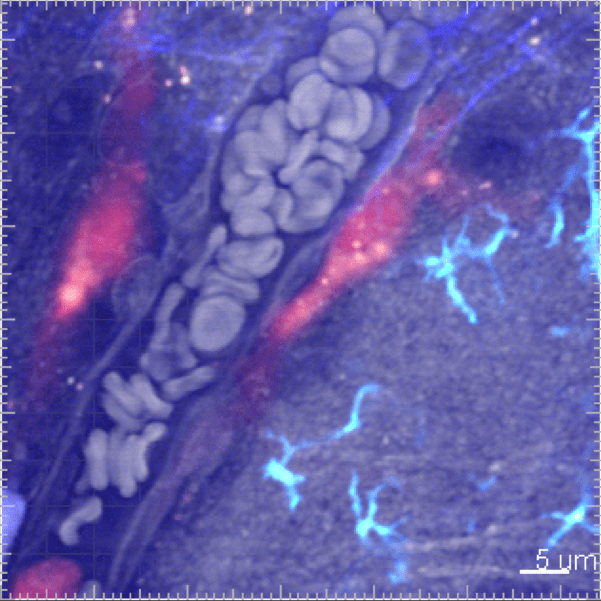
Les cellules myéloïdes sont soumises à un trafic très intense et rapide entre la vascularisation sanguine et le tissu. Nous développons des études in vivo pour surveiller la cinétique de leur mobilisation à travers différents tissus et suivre leur comportement par imagerie en temps réel in vivo.
2. Dysfonction de la réponse immune innée
Le dysfonctionnement de l’immunité innée est une cause majeure de la physiopathologie de nombreuses maladies inflammatoires telles que le sepsis, le COVID et les cancers. L’immunomonitoring des cellules immunitaires innées par des approches « omiques » comme la cytométrie de masse, le séquençage de l’ARN et l’imagerie multiplex nous permet de déchiffrer les altérations phénotypiques et fonctionnelles et de découvrir des biomarqueurs à des fins thérapeutiques.
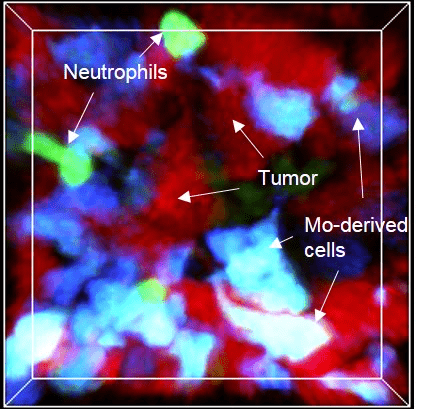
3. Origine et fonction des phagocytes dans la réponse inflammatoire
La connaissance du système des phagocytes mononucléaires a considérablement évolué au cours de la dernière décennie. Le concept d’origine phagocytaire a soulevé de nouvelles questions importantes sur la contribution respective des macrophages résidents et inflammatoires en réponse à l’infection, au développement du cancer et aux lésions tissulaires. Notre objectif est donc de mieux comprendre la fonction des ces différentes sous populations pour à terme pouvoir les cibler sélectivement afin d’améliorer la résolution de la pathologie.
Les opportunités
- Développements techniques Cytométrie de masse et spectrale, imagerie en direct.
- Du banc au chevet (modèles in vivo et échantillons cliniques)
- Travail d’équipe
- Interactions et collaborations nationales et internationales
Les publications
Tumor-associated macrophage heterogeneity is driven by tissue territories in breast cancer. Laviron M, Petit M, Weber-Delacroix E, Combes AJ, Arkal AR, Barthélémy S, Courau T, Hume DA, Combadière C, Krummel MF, Boissonnas A. Cell Rep. 2022 May 24;39(8):110865. doi: 10.1016/j.celrep.2022.110865. PMID: 35613577 Free article.
Two New Neutrophil Subsets Define a Discriminating Sepsis Signature. Am J Respir Crit Care Med. 2022 Jan 1;205(1):46-59. doi: 10.1164/rccm.202104-1027OC.
Imaging resident and recruited macrophage contribution to Wallerian degeneration. J Exp Med. 2020 Nov 2;217(11):e20200471. doi: 10.1084/jem.20200471. PMID: 32648893 Free PMC article.
Sepsis Triggers a Late Expansion of Functionally Impaired Tissue-Vascular Inflammatory Monocytes During Clinical Recovery. Front Immunol. 2020 Apr 30;11:675. doi: 10.3389/fimmu.2020.00675. eCollection 2020. PMID: 32425929 Free PMC article.
CCR2-Dependent Recruitment of Tregs and Monocytes Following Radiotherapy Is Associated with TNFα-Mediated Resistance. Cancer Immunol Res. 2019 Mar;7(3):376-387. doi: 10.1158/2326-6066.CIR-18-0633. Epub 2019 Jan 29. PMID: 30696630
Macrophages of distinct origins contribute to tumor development in the lung. J Exp Med. 2018 Oct 1;215(10):2536-2553. doi: 10.1084/jem.20180534. Epub 2018 Sep 10. PMID: 30201786 Free PMC article.
CX3CR1-dependent endothelial margination modulates Ly6Chigh monocyte systemic deployment upon inflammation in mice. Blood. 2017 Mar 9;129(10):1296-1307. doi: 10.1182/blood-2016-08-732164. Epub 2016 Dec 23. PMID: 28011675 Free article.