Signalisation et Pathogénèse


L’équipe « Signalisation et Pathogenèse » s’intéresse depuis son origine aux processus inflammatoires et immunitaires en se focalisant sur la voie d’activation du facteur NF-kappaB.
Les recherches sur l’activation et la régulation du système immunitaire sont réalisées au niveau moléculaire et cellulaire, mais aussi en utilisant des modèles animaux et en étudiant des situations cliniques. Nos recherches sur la voie NF-kappaB nous ont conduit à nous intéresser à Optineurine, une protéine impliquée dans l’autophagie/Mitophagie présentant des homologies avec NEMO (modulateur essentiel de la voie NF-kappaB).
En découvrant de nouveaux régulateurs de NF-kappaB et Optineurine, notre ambition est de mieux comprendre leurs fonctionnements et leur dérégulation dans des pathologies immunitaires et neurodégénératives et dans le cancer.



Les membres de l'équipe
Nos recherches se déclinent en 3 axes
- Immunité innée et adaptative
- Signalisation NF-kappaB
- Autophagie et mitochondries
- SARS-CoV2
- Maladies neurodégénératives
- Cancer : myélome multiple et lymphome du manteau
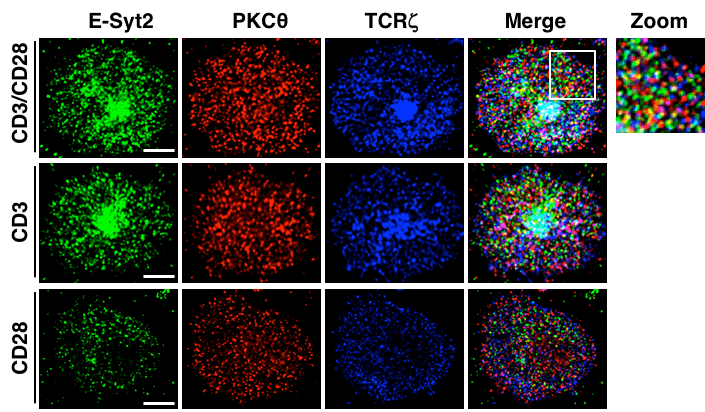
1. Identification d’un nouvel effecteur de la voie NF-B induite par une stimulation antigénique
Ce projet montre que la protéine E-Syt2 joue un rôle important dans la signalisation NF-kappaB en réponse à une stimulation antigénique et dans la différentiation des iNKT, un sous-ensemble de cellules T de type inné, réactives aux glycolipides.
Cette protéine met en place des jonctions entre le réticulum endoplasmique et la membrane plasmique pour permettre des échanges de lipides.
Nous travaillons sur l’hypothèse qu’E-Syt2 présente un double rôle dans l’immunité antitumorale pour 1) permettre l’activation des iNKT à travers la signalisation NF-kappaB et 2) présenter des lipides immunogènes aux iNKT.
2. Etudes des pathologies associées aux dysfonctionnements du récepteur d’autophagie Optineurine
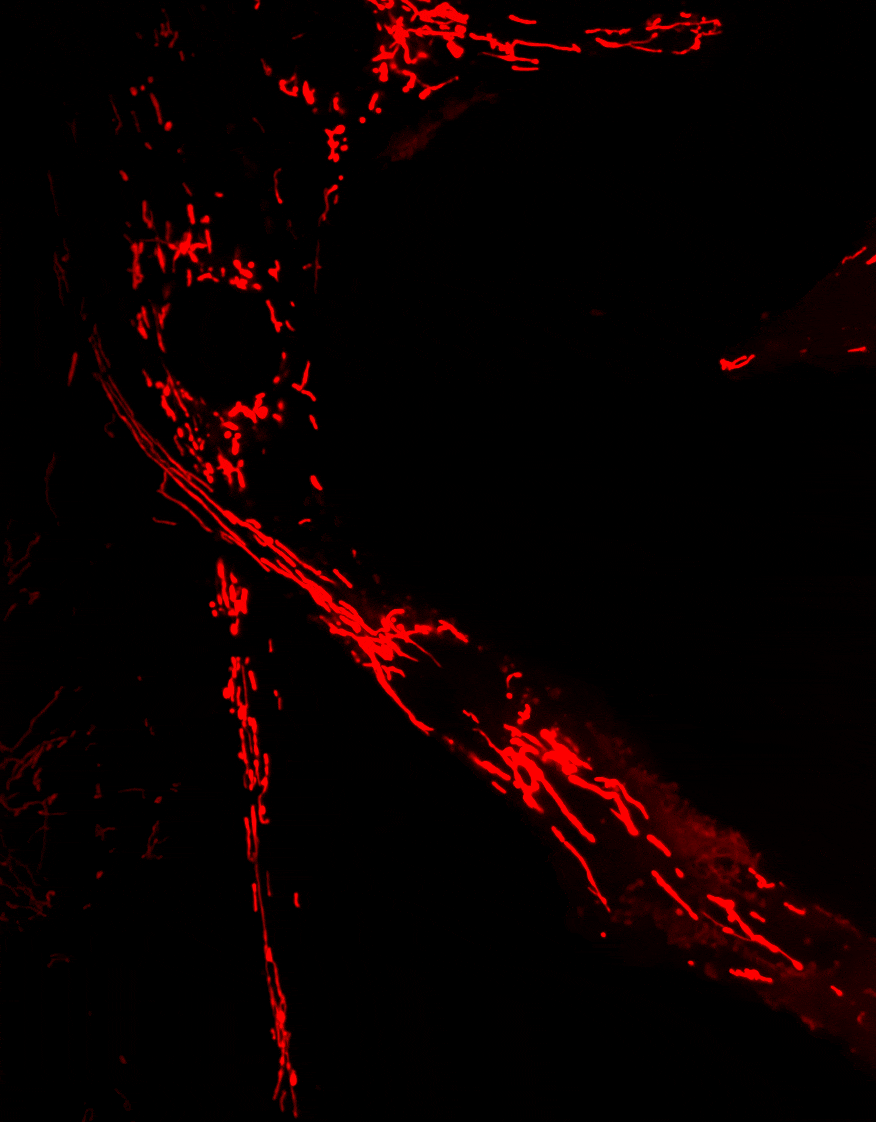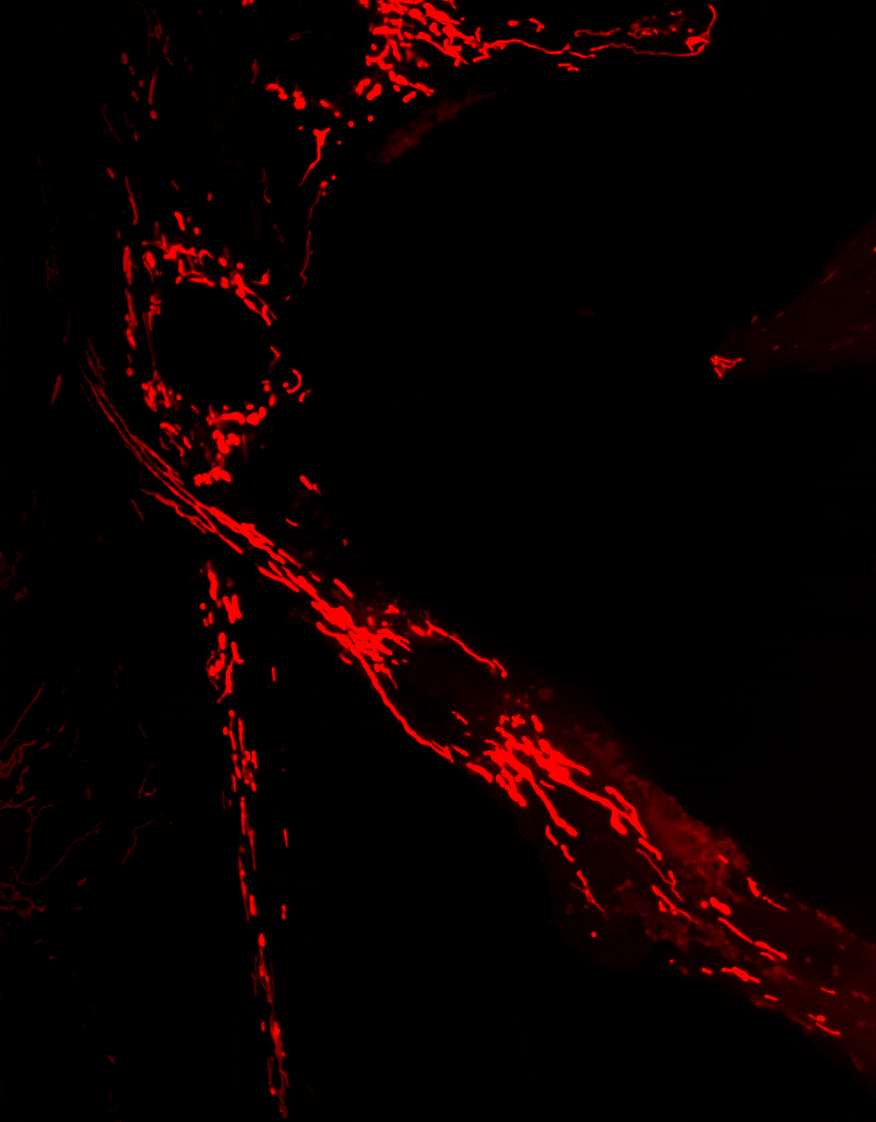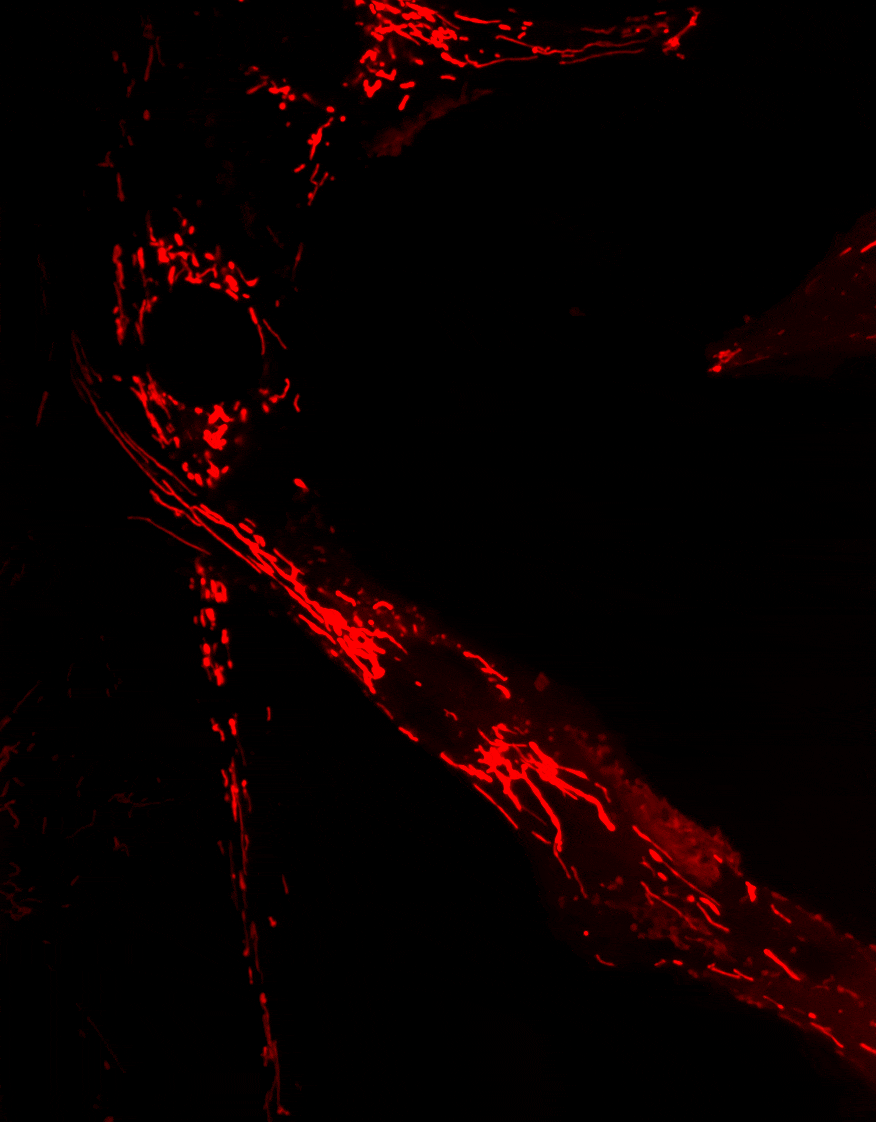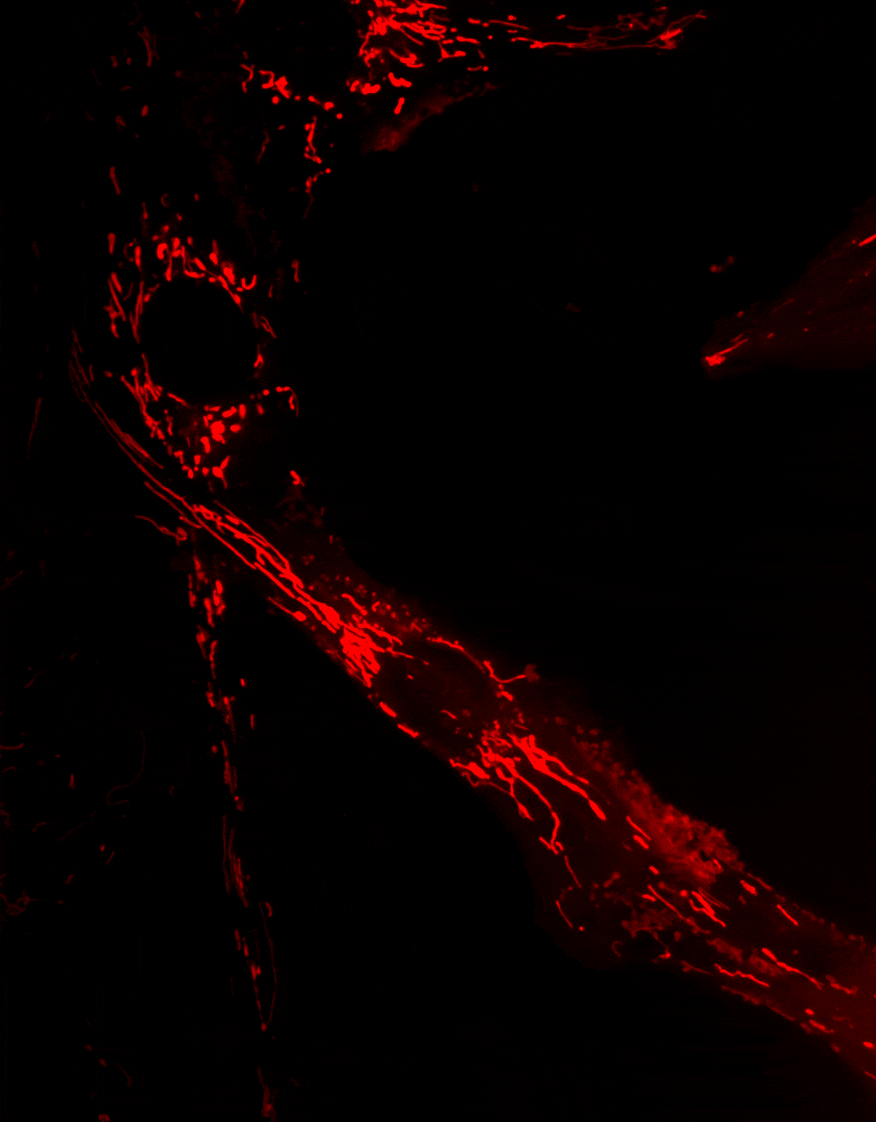
Optineurine (OPTN) est une protéine impliquée dans de nombreux processus cellulaires, incluant le trafic membranaire, le cycle cellulaire, la réponse immunitaire antivirale et l’autophagie sélective
La mitophagie, un mécanisme essentiel permettant l’élimination des mitochondries endommagées, est altérée dans plusieurs maladies neurodégénératives. Des mutations du gène Optn ont été identifiées dans des pathologies telles que le glaucome et la sclérose latérale amyotrophique (SLA).
Nos travaux visent à comprendre le rôle d’OPTN dans le transport et l’élimination des mitochondries, et à déterminer comment les dysfonctionnements de ces processus contribuent au développement de maladies neurodégénératives.
3. Signalisation NF-kappaB et recherche de cibles thérapeutiques
Ce projet s’intéresse aux mécanismes moléculaires régulant la voie NF-kappaB activée par des cytokines inflammatoires telles que le TNF ou l’IL-1, en particulier les processus dépendants de l’ubiquitination dégradative et non-dégradative.
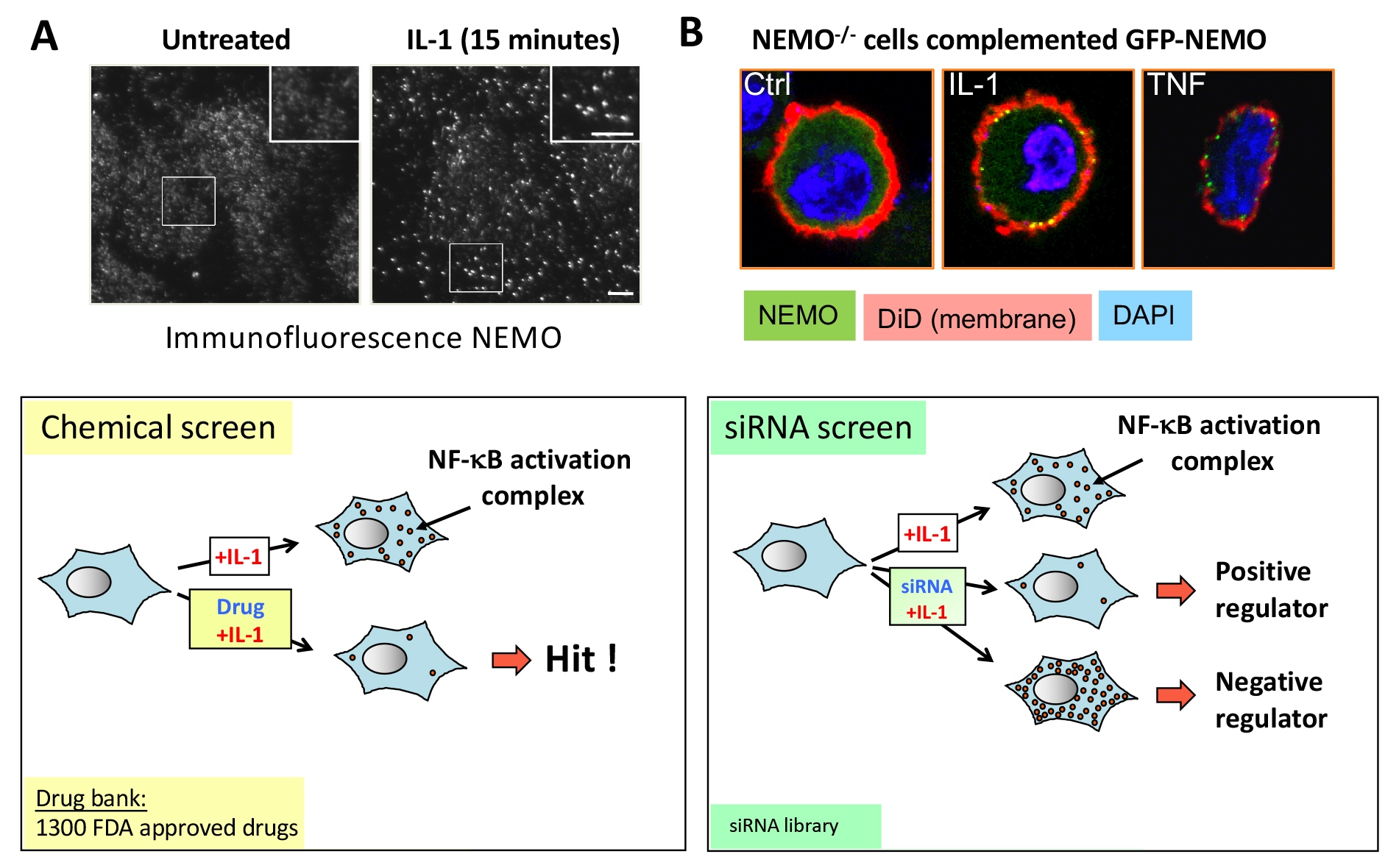
Nous avons montré que l’IL-1 induit le recrutement rapide et transitoire du complexe NEMO/IKK dans des structures supramoléculaires juxta-membranaires nécessaires à l’activation de NF-kappaB. Nous avons utilisé cette découverte pour réaliser des criblages pharmacologiques (médicaments approuvés par la FDA) et génétiques (siARNs). Ces approches ont permis d’identifier de nouveaux régulateurs et inhibiteurs de ces complexes d’activation de NF-kappaB. Ainsi nous avons montré que l’Auranofine, inhibe NF-kappaB et bloque l’entrée du virus SARS-CoV-2 dans les cellules faisant de cette molécule un traitement potentiel de la COVID-19.
Les composés et régulateurs identifiés font actuellement l’objet d’études approfondies et pourraient constituer de nouvelles cibles thérapeutiques.
Par ailleurs, nous étudions deux cancers hématologiques, le myélome multiple et le lymphome du manteau, dans lesquels l’activation chronique de la voie NF-kappaB contribue à la survie des cellules tumorales, afin d’identifier des vulnérabilités thérapeutiques en ciblant cette voie, seule ou en combinaison avec d’autres voies de signalisation.
Les opportunités
- Nouvelles stratégies thérapeutiques : immunité / neurodégénération / cancer
- Repositionnement de médicament pour traiter la COVID-19
- Mécanismes de signalisation, phosphorylation et ubiquitination
- Compartimentation cellulaire, imagerie
- Biologie moléculaire, CRISPR-Cas9
Les publications
[Optineurin and mitochondrial dysfunction in neurodegeneration]. eil R Med Sci (Paris). 2024 Feb;40(2):167-175. doi: 10.1051/medsci/2023220. Epub 2024 Feb 27
Phosphorylation of Optineurin by protein kinase D regulates Parkin-dependent mitophagy. Weil R, Laplantine E, Attailia M, Oudin A, Curic S, Yokota A, Banide E, Génin P. iScience. 2024 Nov 13;27(12):111384. doi: 10.1016/j.isci.2024.111384. eCollection 2024 Dec 20. PMID: 39669425
The FDA-approved drug Auranofin has a dual inhibitory effect on SARS-CoV-2 entry and NF-κB signaling. iScience. 2022 Sep 3:105066. doi: 10.1016/j.isci.2022.105066. Online ahead of print. PMID: 36093378 Free PMC article.
NF-κB: At the Borders of Autoimmunity and Inflammation. Front Immunol. 2021 Aug 9;12:716469. doi: 10.3389/fimmu.2021.716469. eCollection 2021. PMID: 34434197 Free PMC article.
Two NEMO-like Ubiquitin-Binding Domains in CEP55 Differently Regulate Cytokinesis. Said Halidi KN, Fontan E, Boucharlat A, Davignon L, Charpentier M, Boullé M, Weil R, Israël A, Laplantine E, Agou F. iScience. 2019 Oct 25;20:292-309. doi: 10.1016/j.isci.2019.08.042. Epub 2019 Sep 25. PMID: 31605944
Role of Optineurin in the Mitochondrial Dysfunction: Potential Implications in Neurodegenerative Diseases and Cancer. Front Immunol. 2018 Jun 19;9:1243. doi: 10.3389/fimmu.2018.01243. eCollection 2018. PMID: 29971063 Free PMC article.
Regulation of TBK1 activity by Optineurin contributes to cell cycle-dependent expression of the interferon pathway. Cytokine Growth Factor Rev. 2016 Jun;29:23-33. doi: 10.1016/j.cytogfr.2016.03.001. Epub 2016 Mar 4. PMID: 26976762
Human HOIP and LUBAC deficiency underlies autoinflammation, immunodeficiency, amylopectinosis, and lymphangiectasia. Boisson B, Laplantine E, Dobbs K, Cobat A, Tarantino N, Hazen M, Lidov HG, Hopkins G, Du L, Belkadi A, Chrabieh M, Itan Y, Picard C, Fournet JC, Eibel H, Tsitsikov E, Pai SY, Abel L, Al-Herz W, Casanova JL, Israel A, Notarangelo LD. J Exp Med. 2015 Jun 1;212(6):939-51. doi: 10.1084/jem.20141130. Epub 2015 May 25. PMID: 26008899
Optineurin regulates the interferon response in a cell cycle-dependent manner. PLoS Pathog. 2015 Apr 29;11(4):e1004877. doi: 10.1371/journal.ppat.1004877. eCollection 2015 Apr. PMID: 25923723 Free PMC article.
TNF and IL-1 exhibit distinct ubiquitin requirements for inducing NEMO-IKK supramolecular structures. Tarantino N, Tinevez JY, Crowell EF, Boisson B, Henriques R, Mhlanga M, Agou F, Israël A, Laplantine E. J Cell Biol. 2014 Jan 20;204(2):231-45. doi: 10.1083/jcb.201307172. PMID: 24446482
Immunodeficiency, autoinflammation and amylopectinosis in humans with inherited HOIL-1 and LUBAC deficiency. Boisson B, Laplantine E, Prando C, Giliani S, Israelsson E, Xu Z, Abhyankar A, Israël L, Trevejo-Nunez G, Bogunovic D, Cepika AM, MacDuff D, Chrabieh M, Hubeau M, Bajolle F, Debré M, Mazzolari E, Vairo D, Agou F, Virgin HW, Bossuyt X, Rambaud C, Facchetti F, Bonnet D, Quartier P, Fournet JC, Pascual V, Chaussabel D, Notarangelo LD, Puel A, Israël A, Casanova JL, Picard C. Nat Immunol. 2012 Dec;13(12):1178-86. doi: 10.1038/ni.2457. Epub 2012 Oct 28. PMID: 23104095
Toward an integrative view of Optineurin functions. Cell Cycle. 2012 Aug 1;11(15):2808-18. doi: 10.4161/cc.20946. Epub 2012 Aug 1. PMID: 22801549