Microenvironnement
Immunitaire et
Immunothérapie

L’Equipe « Microenvironnement Immunitaire et Immunothérapie » est composée de scientifiques et de cliniciens possédant des expertises très fortes et complémentaires dans les domaines de l’immunologie des tumeurs et de l’immunothérapie, chez l’homme comme chez l’animal.
Les membres de notre équipe sont également très impliqués dans l’enseignement universitaire, et collaborent avec des partenaires hospitaliers et de l’industrie pharmaceutique au niveau international.
Sur la base de nos travaux pionniers rapportant la présence et la valeur pronostique favorable des Structures Lymphoïdes Tertiaires (TLS) chez les patients cancéreux, avec une analyse approfondie dans les cancers du poumon, notre programme de recherche s’intéresse aujourd’hui à la relation entre les TLS et son microenvironnement tumoral chez les patients atteints d’un cancer du poumon ou de la tête et du cou, et à la manipulation des TLS à visée thérapeutique dans des modèles pré-cliniques relevants.

Les membres de l'équipe
Nos recherches se déclinent en 3 axes
- Structure Lymphoïde Tertiaire
- Immunologie des tumeurs humaines et murines
- Immunité cellulaire et humorale
- Manipulation thérapeutique des TLS
- Vaccination curative
- Carcinomes du poumon et de la tête et du cou
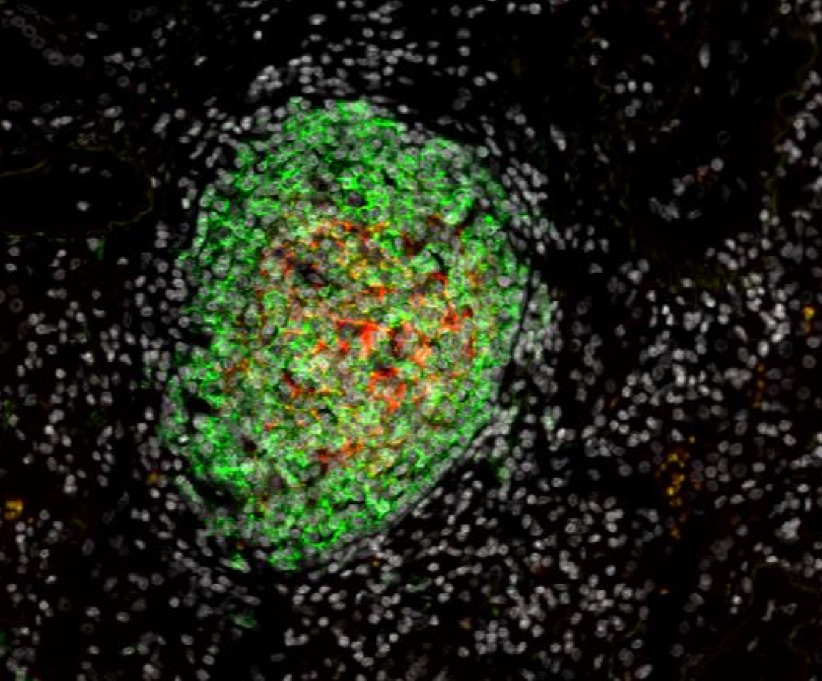
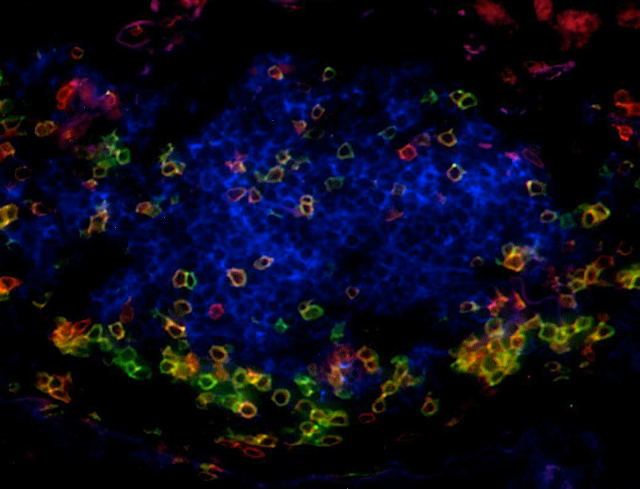
1. Analyse de la fonction immunitaire des Structures Lymphoïdes Tertiaires (TLS)
Nos travaux ont mis en évidence que la présence de TLS est corrélée au statut d’activation, à une polarisation Th1 et à une activité cytotoxique des lymphocytes, et qu‘elles sont également indispensables pour prédire la valeur pronostique des lymphocytes T CD8+.
De plus, les lymphocytes B des TLS corrèlent avec la présence de plasmocytes sécrétant des anticorps dirigés contre des antigènes tumoraux.
Une attention particulière est actuellement mise sur la relation entre TLS, les caractéristiques moléculaires de la tumeur et la fonctionnalité des lymphocytes T et B intra-tumoraux dans le but d’identifier de nouvelles interactions cellulaires impliquées dans le développement des réponses anti-tumorales efficaces.
2. Caractérisation de molécules et cellules contrôlant la formation et la persistance des TLS
Nos études visent à explorer les déterminants cellulaires et moléculaires qui sont essentiels dans l’induction et le maintien du TLS dans le microenvironnement tumoral (carcinomes du poumon et de la tête et du cou).
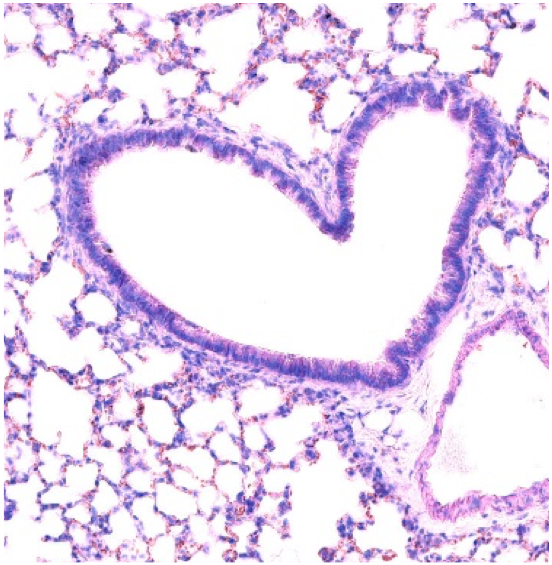
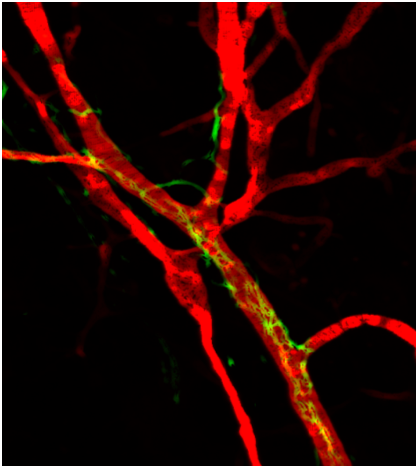
En combinant des approches cellulaires et moléculaires dans des modèles murins et en utilisant des biopsies de tumeurs humaines, nos objectifs sont : i) de définir la ou les populations cellulaires impliquées dans la genèse du TLS dans diverses conditions inflammatoires; ii) d’évaluer le rôle de la néovascularisation et des fibres nerveuses dans la formation et le maintien des TLS; et iii) de définir des molécules solubles et membranaires qui participent à la genèse du TLS.
3. Développement d'immunothérapies basées sur le ciblage des TLS
La présence de TLS dans un grand nombre de tumeurs solides a été associée à un pronostic plus favorable.
Ainsi, la capacité à générer et à maintenir des TLS fonctionnelles dans le microenvironnement tumoral (TME) représente une nouvelle approche d’immunothérapie intéressante pour contrôler la croissance tumorale et induire une immunosurveillance puissante et durable contre les cellules cancéreuses.
Nous développons actuellement des molécules de fusion à base d’anticorps (Ab) et d’autres formats d’Ab pour déclencher et/ou renforcer la présence de TLS fonctionnelles dans le TME. Leur capacité à recruter et à stimuler des cellules de type inducteur tissulaire lymphoïde (cellules LTi-like) sont étudiées dans divers modèles ainsi que différentes voies d’administration in vivo basées sur l’utilisation de lipopolyplexes et de virus.
Les opportunités
- Identification de molécules initiatrices de la néogenèse des TLS et de leur propriété anti-tumorale
- Thérapies combinatoires à base d’anticorps conduisant des remaniements profonds du microenvironnement tumoral
- Optimisation d’immunothérapies anti-cancéreuses avec le développement de nouveaux vaccins thérapeutiques
- Recherche de nouveaux biomarqueurs pronostiques et prédictifs de la réponse aux traitements dans les cancers
Les publications
Absence of sympathetic innervation hampers the generation of tertiary lymphoid structures upon acute lung inflammation. Sci Rep. 2024 May 23;14(1):11749. doi: 10.1038/s41598-024-62673-0.
Enkephalin-mediated modulation of basal somatic sensitivity by regulatory T cells in mice. N Aubert, M Purcarea, M Fornier, L Cagnet, M Naturel, A Casrouge, G Dietrich, M-C Dieu-Nosjean, G Marodon. eLife. 2024 February 1.
[The Nobel Prize in Physiology or Medicine 2023: Katalin Karikó and Drew Weissman – A vaccine revolution driven by fundamental research in immunology and molecular biology]. Med Sci (Paris). 2024 Feb;40(2):186-191. doi: 10.1051/medsci/2024002. Epub 2024 Feb 27.
SAR442085, a novel anti-CD38 antibody with enhanced antitumor activity against multiple myeloma. Blood. 2022 Feb 24;139(8):1160-1176. doi: 10.1182/blood.2021012448. PMID: 35201323
BMFPs, a versatile therapeutic tool for redirecting a preexisting Epstein-Barr virus antibody response toward defined target cells. Sci Adv. 2022 Feb 11;8(6):eabl4363. doi: 10.1126/sciadv.abl4363. Epub 2022 Feb 11. PMID: 35148183 Free PMC article.
Tumor-Associated Tertiary Lymphoid Structures: A Cancer Biomarker and a Target for Next-generation Immunotherapy. Adv Exp Med Biol. 2021;1329:51-68. doi: 10.1007/978-3-030-73119-9_3. PMID: 34664233
Tertiary Lymphoid Structure-B Cells Narrow Regulatory T Cells Impact in Lung Cancer Patients. Front Immunol. 2021 Mar 8;12:626776. doi: 10.3389/fimmu.2021.626776. eCollection 2021. PMID: 33763071 Free PMC article.
Blockade of HVEM for Prostate Cancer Immunotherapy in Humanized Mice. Cancers (Basel). 2021 Jun 16;13(12):3009. doi: 10.3390/cancers13123009. Free PMC article.
Tumor-Associated Tertiary Lymphoid Structures: From Basic and Clinical Knowledge to Therapeutic Manipulation. Front Immunol. 2021 Jun 30;12:698604. doi: 10.3389/fimmu.2021.698604. eCollection 2021. PMID: 34276690 Free PMC article.
Effective control of Staphylococcus aureus lung infection despite tertiary lymphoid structure disorganisation. Eur Respir J. 2021 Apr 15;57(4):2000768. doi: 10.1183/13993003.00768-2020. Print 2021 Apr. PMID: 33093122
Intratumoral plasma cells: More than a predictive marker of response to anti-PD-L1 treatment in lung cancer? Cancer Cell. 2022 Mar 14;40(3):240-243. doi: 10.1016/j.ccell.2022.02.008. Epub 2022 Feb 24. PMID: 35216677
A novel combination of chemotherapy and immunotherapy controls tumor growth in mice with a human immune system. Oncoimmunology. 2019 Apr 12;8(7):1596005. . eCollection 2019. Free PMC article.