Pathogenèse
du paludisme
sévère

Notre équipe de recherche se focalise sur l’identification et le décryptage des interactions moléculaires associées à la séquestration des globules rouges parasités par P. falciparum au cours du paludisme placentaire (PM) et du paludisme cérébral. La compréhension des caractéristiques fonctionnelles des processus d’adhésion du parasite au niveau moléculaire fournira une base rationnelle afin d’accélérer le développement de vaccins et de thérapies visant à inhiber la séquestration des globules rouges parasités à l’origine des formes sévères du paludisme.
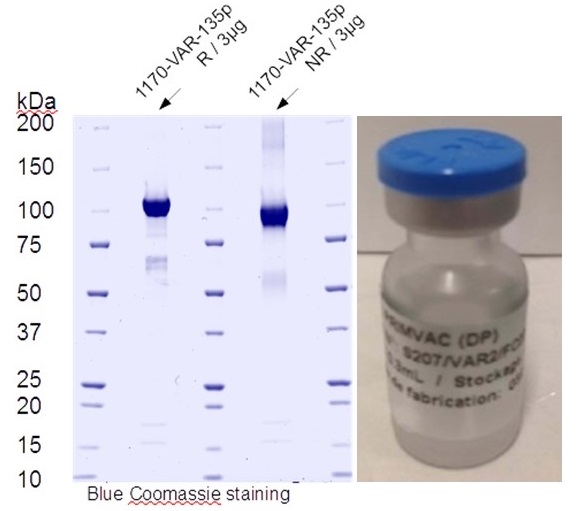
Cette stratégie, qui est l’ADN de notre équipe depuis sa création est à l’origine du développement du vaccin PRIMVAC visant à prévenir le paludisme gestationnel qui a été évalué en essai clinique de Phase I et pour lequel 3 autres essais cliniques dont une phase II sont programmés.
Les membres de l'équipe
Nos recherches se déclinent en 3 axes
- Malaria
- Plasmodium
- Grossesse
- Anticorps
- Vaccins
- Thérapies
1. Interactions hôte-parasite associées aux formes graves de paludisme
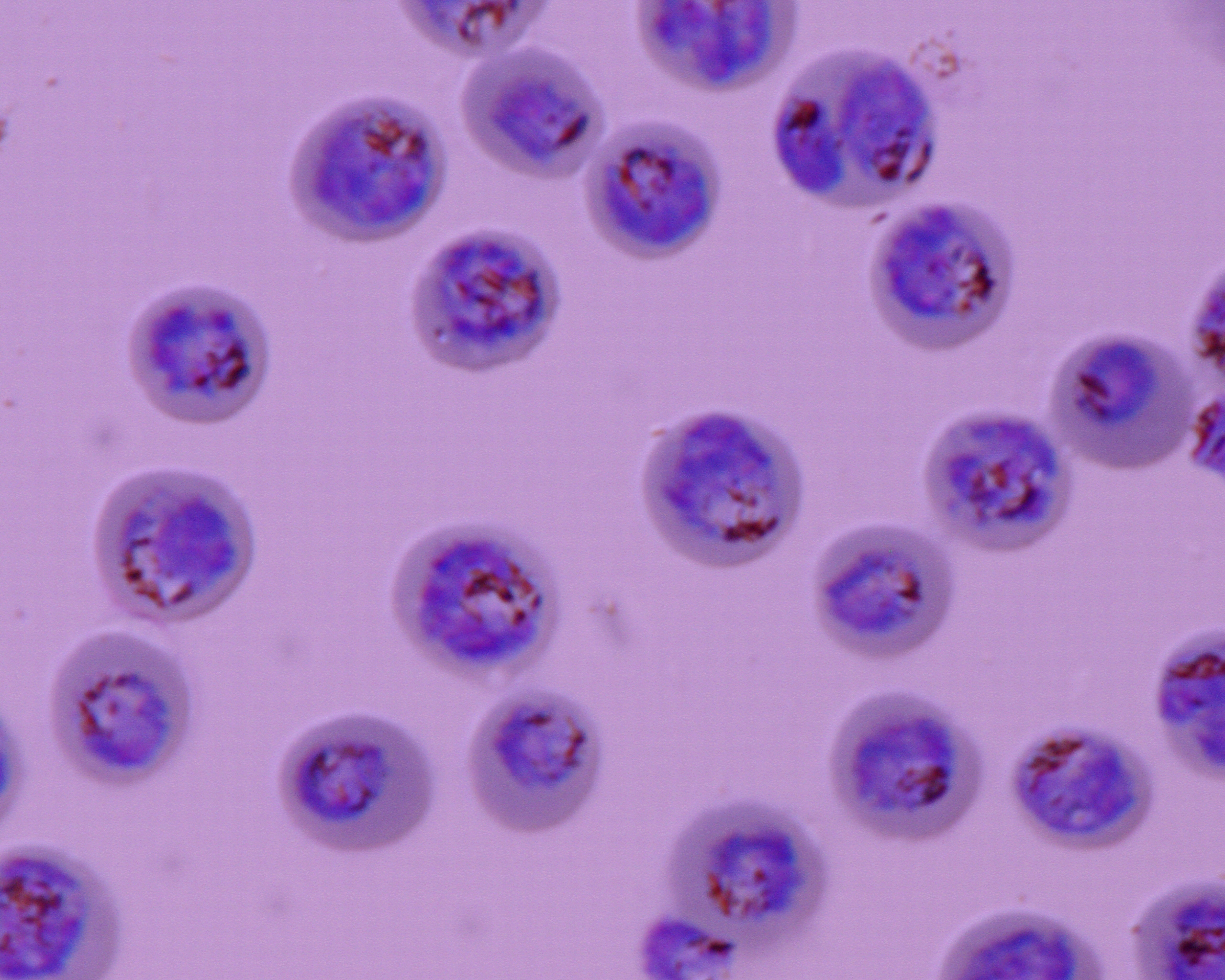
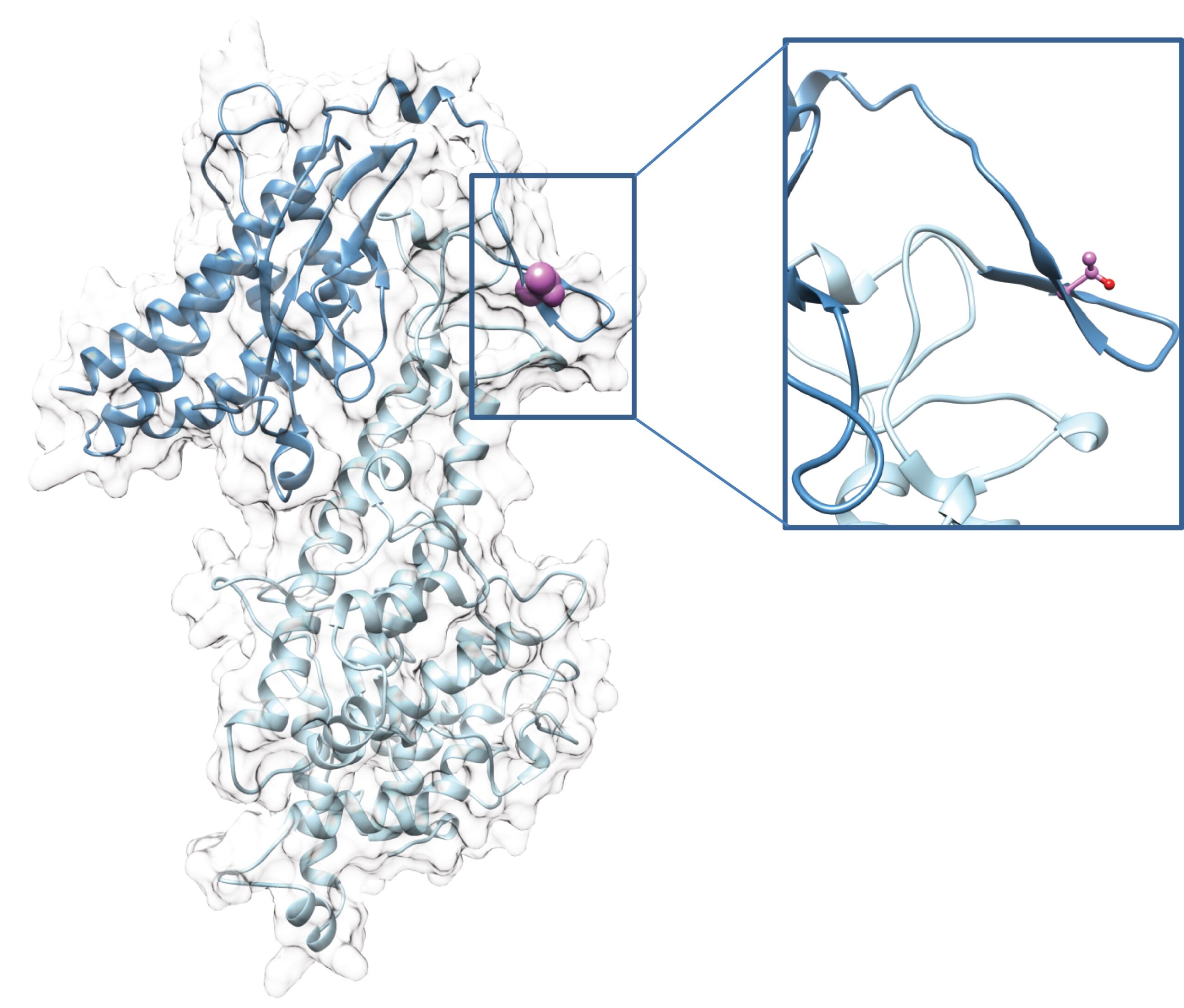
Nous nous concentrons sur l’identification et le décryptage des interactions moléculaires à l’origine de la séquestration des hématies parasitées associées au paludisme placentaire ainsi qu’au paludisme cérébral. Ces données permettent de fournir une base rationnelle afin d’accélérer le développement de vaccins et de traitements visant à inhiber la séquestration des globules rouges parasités et donc à prévenir la pathogenèse et/ou à guérir le paludisme grave. Nous évaluons également comment les modifications post-traductionnelles des adhésines parasitaires exprimées à la surface des globules rouges parasités modulent leur trafic vers la surface du globule rouge et leur cytoadhérence aux récepteurs de l’hôte.
2. Développement de vaccins
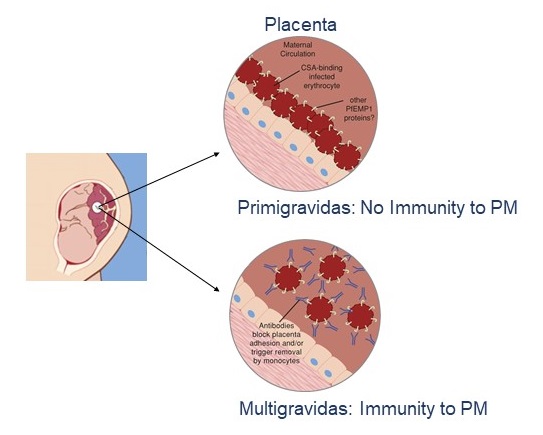
Un vaccin qui préviendrait le paludisme à P. falciparum chez les femmes enceintes permettrait de sauver des centaines de milliers de vies chaque année. Les résultats des essais cliniques de phase Ia/b montrent que notre vaccin PRIMVAC visant à prévenir le paludisme placentaire a été bien toléré et a induit une forte réponse immunitaire chez toutes les femmes vaccinées, avec la production d’anticorps qui ont persisté pendant plus d’un an. Nous caractérisons actuellement la longévité de la réponse immunitaire induite par PRIMVAC chez les femmes du Burkina Faso et la capacité de PRIMVAC à stimuler et élargir une réponse immunitaire naturelle acquise chez les femmes primigestes et multigravides. De plus, en collaboration avec European Vaccine Initiative (EVI), le vaccin PRIMVAC va être testé dans un essai clinique de phase II en Afrique. Nous travaillons également sur le développement d’un vaccin de deuxième génération qui pourrait élargir la réponse immunitaire contre les différents variants de VAR2CSA et sur le développement d’un vaccin à base d’ARNm.
3. Développement de nouvelles approches d’immunothérapies
Nous développons au sein de cet axe des anticorps monoclonaux humains contre VAR2CSA qui pourraient bloquer la liaison des globules rouges parasités au placenta. Nous développons et caractérisons également des VHH/nanobodies contre les antigènes du parasite exprimés à différentes étapes du cycle de vie du parasite. Les nanobodies combinent les avantages des activités de liaison des anticorps avec les propriétés des petites molécules et peuvent être conçus pour ajouter des molécules. Dans ce contexte, nous avons développé une nouvelle approche d’immunothérapie redirigeant une réponse en anticorps polyclonaux préexistante contre le virus d’Epstein-Barr (EBV). Notre objectif est de créer des protéines de fusion bi-modulaires (BMFP) capables de recruter des anticorps polyclonaux endogènes de haute affinité (anti-EBV) contre les globules rouges parasités par P. falciparum. Les BMFP seront conçus sur la base d’un antigène EBV (P18) couplé à des fragments de liaison dérivés de nanobodies ciblant les antigènes de P. falciparum (Pf) spécifiquement exprimés à la surface des globules rouges infectées par des formes de parasites asexués ou sexués.
Les opportunités
- Mécanismes de cytoadhérence
- Développement de vaccins contre le paludisme
- Expression de protéines recombinantes
- Développement d’Anticorps humains monoclonaux et de VHH
- Nouvelles stratégies thérapeutiques
Les publications
Casein Kinases 2-dependent phosphorylation of the placental ligand VAR2CSA regulates Plasmodium falciparum-infected erythrocytes cytoadhesion. PLoS Pathog. 2025 Jan 13;21(1):e1012861.
JK–1, a useful erythroleukemic cell line model to study a controlled erythroid differentiation from progenitors to terminal erythropoiesis. Sci Rep. 2024 Oct 29;14(1):25885.
Sustained clinical benefit of malaria chemoprevention with sulfadoxine-pyrimethamine (SP) in pregnant women in a region with high SP resistance markers. J Infect. 2024 May;88(5):106144. doi: 10.1016/j.jinf.2024.106144. Epub 2024 Apr 2.
Duffy antigen is expressed during erythropoiesis in Duffy-negative individuals. Cell Host Microbe. 2023 Dec 13;31(12):2093-2106.e7. doi: 10.1016/j.chom.2023.10.019. Epub 2023 Dec 5.
Aotus nancymaae model predicts human immune response to the placental malaria vaccine candidate VAR2CSA. Lab Anim (NY). 2023 Dec;52(12):315-323. doi: 10.1038/s41684-023-01274-2. Epub 2023 Nov 6.
Detecting temporal and spatial malaria patterns from first antenatal care visits. Nat Commun. 2023 Jul 6;14(1):4004. doi: 10.1038/s41467-023-39662-4.
Malaria-specific Type 1 regulatory T cells are more abundant in first pregnancies and associated with placental malaria. EBioMedicine. 2023 Sep;95:104772. doi: 10.1016/j.ebiom.2023.104772. Epub 2023 Aug 25.
Associations between prenatal malaria exposure, maternal antibodies at birth, and malaria susceptibility during the first year of life in Burkina Faso. Infect Immun. 2023 Oct 17;91(10):e0026823. doi: 10.1128/iai.00268-23. Epub 2023 Sep 27.
An ACE2-Based Bimodular Fusion Protein Enables Reorientation of Endogenous Anti-Epstein-Barr Virus Antibodies Toward SARS-CoV-2 Spike. J Infect Dis. 2023 Dec 20;228(12):1675-1679. doi: 10.1093/infdis/jiad329.
Detecting temporal and spatial malaria patterns from first antenatal care visits. Res Sq [Preprint]. 2023 Feb 20:rs.3.rs-2592126. doi: 10.21203/rs.3.rs-2592126/v1.
Expression and Purification of scFv2H7-P18F3, a Bi-Modular Fusion Protein (BMFP) Targeting Human CD20. Bio Protoc. 2023 May 20;13(10):e4682. doi: 10.21769/BioProtoc.4682. eCollection 2023 May 20
Evaluation of Malarial Var2CSA-Displaying Baculovirus Vector in Transduction Efficiency in Human Cancer Cells. Biol Pharm Bull. 2023;46(3):404-411. doi: 10.1248/bpb.b22-00630.